- COLLAGÈNE
- COLLAGÈNEDe nature glycoprotidique, le collagène est une macromolécule fibreuse, très répandue dans le règne animal et qui, chez l’homme, représente approximativement un tiers des protéines de l’organisme. Il est plus exact de parler des collagènes, car il y a plusieurs sortes de collagènes qui diffèrent dans leur structure, dans leur composition et dans leur distribution au sein des tissus et des organes d’un même organisme, sans parler des différents collagènes, isolés, identifiés et étudiés à partir d’espèces animales très diverses.Du point de vue phylogénétique, le collagène est apparu dès les premiers métazoaires, les Porifera ou éponges dont on connaît l’utilisation depuis la Haute Antiquité. Il faut remarquer que l’«invention» du collagène, à cette étape relativement précoce de la phylogenèse, ainsi que de certaines autres macromolécules de la matrice intercellulaire comme les glycoprotéines de structure, est liée à l’apparition des Métazoaires, c’est-à-dire des animaux pluricellulaires. Le collagène, avec les autres macromolécules de la matrice intercellulaire (les protéoglycannes, les glycoprotéines de structure et l’élastine), constitue un système de cohésion qui a permis l’assemblage des cellules en tissus, des tissus en organes et des organes en un organisme. La grande variété des tailles et des formes caractérisant les êtres vivants apparus sur la terre au cours de la phylogenèse est en grande partie due à la variation de la qualité et de la quantité de ces macromolécules de la matrice intercellulaire et en particulier du collagène.1. Divers types de collagèneDéjà chez les Porifera (ou Spongiaires), on retrouve plusieurs types de collagènes, comme les fines fibrilles de collagène intercellulaire, (spongine A), et les grosses fibres, macroscopiquement visibles, qui forment la trame solide de ces animaux que J. Gross, qui les a le premier étudiées, a appelé la spongine B. On trouve des collagènes sous d’autres formes moléculaires et microscopiques dans la paroi des vers de terre et chez la quasi-totalité des espèces animales. Sous des formes différentes, chez l’homme, le collagène joue un rôle important en tant que composant macromoléculaire principal de la trame fibreuse calcifiable des os, des cartilages, des ligaments, des tendons, des capsules articulaires, de l’œil (cornée, corps vitré, capsule cristallinienne, rétine), du derme, des plèvres, péritoine et autres revêtements et capsules d’organes parenchymateux et de cavités de l’organisme. On le retrouve aussi à l’intérieur des organes parenchymateux en tant que principal composant des cloisons, dans les parois vasculaires, de la lame basale des capillaires jusqu’aux parois des gros vaisseaux, dans la sous-muqueuse des organes digestifs, les méninges, les couches protectrices des muscles (perimysium, endomysium) et des nerfs (perineurium).Plusieurs types génétiquement distincts de collagènes sont connus chez l’homme. La structure du collagène peut être caractérisée par la description de sa forme la plus répandue chez l’homme, c’est-à-dire du collagène du type I. Cette molécule se forme au cours de sa biosynthèse dans la cellule à partir d’un précurseur, le procollagène (cf. infra ). Au sortir de la cellule, il est devenu un bâtonnet d’environ 300 nanomètres de long et d’environ 16 nanomètres d’épaisseur que l’on appelle le tropocollagène . Cette molécule comprend une longue partie centrale, formée à partir de trois chaînes peptidiques, enroulées en triple hélice. Les deux extrémités de ce bâtonnet en triple hélice sont plus lâches, on les appelle télopeptidiques. Les trois chaînes 見 peuvent être séparées par chauffage à une température dépassant la température de dénaturation du collagène (face=F0019 礪 37 0C), ce qui a comme résultat de transformer le collagène en gélatine (collagène dénaturé). Les trois chaînes 見 constitutives peuvent être séparées par des méthodes physicochimiques telles que chromatographie sur colonne de DEAE cellulose ou électrophorèse sur gel de polyacrylamide. Les chaînes 見 des différents types de collagènes sont distinguées par des indices suivis par un chiffre romain qui désigne le type de collagène à partir duquel cette chaîne 見 a été obtenue. Le tableau 1 montre les différents types de collagènes identifiés (début 1982), chez l’homme. Quand nous parlons de type de collagènes, nous entendons des molécules formées de chaînes 見 (3 par molécule de tropocollagène) dont la séquence d’aminoacides est distincte d’un type de collagène à l’autre. On peut donc assurer que ces chaînes 見 et différents types de collagènes sont codées par des gènes de structure distincts. Ainsi, pour les huit types (environ) de collagènes identifiés jusqu’ici chez l’homme, on peut dénombrer environ deux à trois fois plus de chaînes 見 différentes, ce qui montre le nombre relativement important de gènes de structure devant coder, pour ces chaînes peptidiques élémentaires, du collagène, sans parler des gènes de régulation qui en assurent l’assemblage et l’expression différentielle d’une cellule à l’autre. Dans le tableau 1, nous avons également indiqué la répartition tissulaire de ces différents types de collagènes. Ainsi, le collagène de type I est de loin le plus fréquent et se trouve dans la plupart des tissus conjonctifs tels que le derme, l’os, la cornée, les parois vasculaires, les tendons, les fascia, etc.Le collagène de type II se trouve dans le cartilage et aussi dans le corps vitré de l’œil. Le collagène de type III se trouve dans le derme et dans la paroi vasculaire. Le collagène de type IV se trouve exclusivement dans les lames basales. Le collagène de type V se trouve autour de certaines cellules mésenchymateuses et est aussi parfois associé aux lames basales. Les autres types de collagènes, encore à l’étude, se trouvent dans la matrice intercellulaire, dans la paroi vasculaire et autour de certains types cellulaires comme les chromatocytes du cartilage et les cellules endothéliales et musculaires lisses des parois vasculaires. On peut distinguer ainsi, d’après la répartition des collagènes, du collagène interstitiel (les types I, II et III), du collagène des lames basales (du type IV) et du collagène péricellulaire (du type V et VI en particulier). Parmi les autres types de collagènes identifiés, mentionnons le collagène EC, synthétisé par les cellules endothéliales vasculaires, ou collagène à courte chaîne également présent dans la paroi vasculaire. Plusieurs types nouveaux ont été récemment identifiés dans le cartilage.Nos connaissances concernant la structure et la répartition du collagène progressent rapidement. D’autres types de collagènes ont été identifiés: IX et X dans les cartilages, les notions concernant les collagènes précédemment reconnus peuvent être modifiées quant à leur structure et leur distribution.2. Composition des collagènesLe collagène est caractérisé par la présence d’aminoacides particuliers comme l’hydroxyproline (face=F0019 力 14 p. 100) et d’hydroxylysine. Ces acides aminés particuliers (fig. 1) sont obtenus par l’hydroxylation de la proline et de la lysine après la synthèse de la chaîne 見 sur les polysomes (cf. chap. 3). On connaît dans le collagène deux isomères de l’hydroxyproline: l’hydroxy 3-proline et l’hydroxy 4-proline. La teneur en 4-hydroxyproline est élevée mais variable d’un type de collagène à l’autre (tabl. 2). Le dosage de l’hydroxyproline permet pratiquement le dosage sélectif du collagène, puisque très peu d’autres protéines en contiennent (c’est le cas de l’élastine, du C1q qui est l’un des composants du complément et d’une certaine forme dite asymétrique de l’acétylcholinestérase). Ces autres protéines en contiennent beaucoup moins, en général moins de 2 p. 100. La 3-hydroxyproline se trouve surtout dans les collagènes des lames basales.Comme l’hydroxyproline, l’hydroxylysine se forme aussi après la synthèse de la chaîne peptidique à partir de la lysine et une partie de cette hydroxylysine est glycosylée en galactosyl-hydroxylysine ou en glucosylgalactosyl-hydroxylysine (fig. 1). Les différents types de collagènes sont plus ou moins riches en glucides, c’est pourquoi nous pouvons dire que les collagènes sont des glycoprotéines. Cette copule glucidique, le glucosylgalactosyl-hydroxylysine, est très caractéristique du collagène et permet de le distinguer des autres glycoprotéines, car ce type de liaison entre galactose et hydro-xylysine en 1 見 n’a pas encore été retrouvé dans d’autres glycoprotéines. La séquence d’aminoacides des collagènes est caractérisée par la présence de la glycine à chaque troisième position, comme dans la séquence caractéristique du triplet: gly-pro-X. Ainsi, la plupart des collagènes contiennent environ 330 résidus pour 1 000 résidus de glycine.Au cours de sa biosynthèse, la forme précurseur du collagène, le procollagène, contient deux extrémités globulaires, à l’extrémité N-terminale et C-terminale de la molécule; ces extrémités peuvent être également glycosylées (surtout la C-terminale) mais avec des chaînes glycanniques N-glycosidiquement liées à la partie peptidique et contenant N-acétyl glucosamine, mannose, galactose et acide N-acétyl-neuraminique. Les collagènes des lames basales sont particulièrement riches en glucides, beaucoup plus que les collagènes interstitiels.3. Biosynthèse du collagènePlusieurs types cellulaires sont capables de synthétiser des collagènes. Les plus étudiés sont les fibroblastes qui «consacrent» de 5 à 15 p. 100 de leur activité biosynthétique à la fabrication des collagènes (de types I et III en particulier). Les chondrocytes du cartilage synthétisent le collagène de type II et les cellules musculaires lisses des parois vasculaires font des types I, III, IV et V et probablement d’autres types aussi. Les cellules endothéliales synthétisent du type III, IV et SC, les kératocytes de la cornée et les ostéoblastes du type I préférentiellement.La biosynthèse du collagène commence dans la cellule, comme lors de la synthèse de toutes les protéines par la «traduction» des gènes de structure riches en «introns». Cette traduction donne naissance à des précurseurs d’ARN-messagers (pro-mARN) dont le découpage donne le messager définitif (mARN) qui s’associe avec les ribosomes et qui est transcrit en chaînes peptidiques. Au fur et à mesure que la chaîne pro-alpha est synthétisée, la proline hydroxylase et la lysine hydroxylase transforment immédiatement le nombre (précisément déterminé) des résidus de proline et de lysine en hydroxyproline, voire en hydroxylysine (fig. 1 et 2) et ce n’est qu’après la terminaison de ces hydroxylations suivie de la glycosylation d’une partie des hydroxylysines que la chaîne pro-alpha peut quitter les complexes ribosomaux (polysomes). La chaîne pro-alpha porte à ses deux bouts les extensions peptidiques C- et N-terminales caractéristiques du procollagène.Dans l’ergastoplasme de la cellule productrice, les trois chaînes alpha vont s’unir en une triple hélice comportant aux deux extrémités des extensions plus ou moins globulaires qui seront ensuite coupées au moment de leur excrétion de la cellule, au niveau de la membrane cellulaire, par des protéases spécifiques que l’on appelle les pro-collagène-peptidases (ou propeptidases) N- et C-terminales (fig. 2), pour ne laisser sortir de la molécule que le tropocollagène, séparées de ses deux bouts N- et C-terminaux. Par un mécanisme encore incomplètement élucidé, une partie des molécules de procollagène fraîchement synthétisée est immédiatement dégradée avant qu’elle quitte la cellule.Récemment, on a pu retrouver le peptide N-terminal dans la circulation. Il peut être déterminé par une méthode radio-immunologique. Son dosage permet de détecter les variations de métabolisme du collagène, par exemple dans les cirrhoses (cf. chap. 4).4. La fibrillogenèseAprès sa sortie de la cellule, le tropocollagène va s’associer avec d’autres molécules de tropocollagène. Dans le cas des collagènes interstitiels, cette association se fait par décalage d’un quart de longueur de chaque molécule par rapport à l’autre et par la formation de protofibrilles élémentaires, probablement par l’association de cinq molécules de tropocollagène, comme indiqué sur les figures 2 et 3. À ce moment-là, une enzyme spécifique, la lysiloxydase, va oxyder quelques résidus de lysyle près des terminaisons (télopeptidiques) des molécules, permettant ainsi la formation des liaisons intercaténaires (ou liaisons pontiques) entre les molécules de tropocollagène voisines (fig. 3). Ces liaisons pontiques sont essentiellement de deux types distincts:– le produit de l’oxydation de la lysine – l’allysine ( 嗀-semi-aldéhyde de l’acide 見-amino-adipique) – peut s’unir avec la fonction 﨎-amine d’une lysine sur la molécule de tropocollagène voisine pour former une base de Schiff:
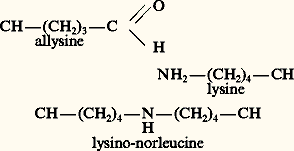 – ou encore, deux résidus d’allysine sur deux molécules de tropocollagène voisines peuvent s’unir pour former un composé aldol (allysine aldol):
– ou encore, deux résidus d’allysine sur deux molécules de tropocollagène voisines peuvent s’unir pour former un composé aldol (allysine aldol):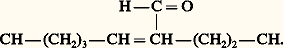 D’autres types de liaisons intercaténaires sont aussi connues. Comme l’hydroxylysine et ses formes glycosylées peuvent également entrer dans ces liaisons pontiques (pour former par exemple l’hydroxy-lysinonorleucine), on connaît un grand nombre de ponts intercaténaires dont la fréquence varie d’un collagène à l’autre et se modifie aussi au cours du développement, au cours de la cicatrisation et au cours d’états pathologiques. Le pontage du collagène peut être inhibé par des agents chélatant le cuivre (cofacteur de la lysyle-oxydase) et en particulier par les lathyrogènes ( 廓-amino propionitrile par exemple). Ces pontages stabilisent les molécules les unes par rapport aux autres et confèrent une très grande rigidité et résistance mécanique aux fibres de collagène. L’épaisseur des fibres est réglée par le nombre de protofibrilles élémentaires juxtaposées. La régulation de cette épaisseur fibrillaire joue un rôle important dans l’organogenèse et dans la morphogenèse. Ainsi, la transparence de la cornée est due à la très grande régularité du diamètre et de l’orientation des fibres de collagène synthétisées (fig. 4), avec une disposition en «patron» hexagonal, bien caractéristique. Dans les taies cornéennes, à la suite de blessures ou de brûlures cornéennes, cette synthèse s’effectue mal, l’épaisseur des fibres devient très variable ainsi que leur orientation, d’où la perte de la transparence de la cornée. Des modifications analogues de structure et de microarchitecture des fibres se retrouvent dans d’autres tissus aussi au cours de modifications pathologiques (fibroses, scléroses, cicatrisation pathologique).Les détails de biosynthèse sont légèrement différents pour les autres types de collagène; ainsi, pour le collagène de type III, la formation de ponts disulfures entre les chaînes 見 s’effectue non seulement au niveau des terminaisons N- et C-terminales, mais aussi dans la partie triple hélicoïdale de la chaîne, et ainsi ces trois chaînes restent plus fortement associées après le découpage des deux terminaisons et ne peuvent être séparées après dénaturation par chauffage, seulement après réduction des ponts disulfures.En ce qui concerne le collagène des lames basales (de type IV), il reste sous forme de procollagène après sa synthèse, les extensions N- et C-terminales ne sont pas coupées. C’est pourquoi ce type de collagène ne forme pas de fibrilles avec une périodicité caractéristique comme les collagènes interstitiels dont la périodicité de 640 nanomètres, très apparente sur les images de microscopie électronique, est due à ce décalage d’un quart de longueur d’une molécule par rapport à l’autre (fig. 5 a).Les différents types de collagène peuvent être caractérisés par des méthodes physico-chimiques, chimiques et ultrastructurales (par microscopie électronique), et par des méthodes histochimiques (microscopie optique). Les collagènes interstitiels peuvent être colorés avec le bleu d’aniline, selon la méthode au trichrome de Masson ou par le vert lumière, mais sa structure fine ne peut être visualisée qu’en microscopie électronique. Une nouvelle méthode permet la coloration sélective en rouge ou jaune du collagène de type I et en vert du collagène de type III (Junqueira).Les méthodes de caractérisation chimique comportent une étape d’extraction et de solubilisation des collagènes nécessitant des solvants tels que le NaCl 0,1 à 0,5 M, l’acide acétique 0,1 N, l’acide citrique, mais, le plus souvent, on a recours à une protéolyse ménagée avec la pepsine suivie de fractionnement par précipitation saline, par filtration sur gel, par chromatographie échangeuse d’ions ou par électrophorèse en gel de polyacrylamide (après séparation des chaînes 見, voir ci-dessus).L’identification des différents types de collagène peut être effectuée in situ par des méthodes immunochimiques (immunofluorescence) en utilisant des anticorps spécifiques ou par extraction, séparation des chaînes 見 et identification par électrophorèse en gel de polyacrylamide, ou, après clivage des molécules par le bromure de cyanogène (CNBr) au niveau des résidus de méthionine, par identification des produits de clivage (CNBr-peptides), par chromatographie sur colonne ou par électrophorèse sur gel de polyacrylamide.5. Pathologie du collagèneDe nombreuses «erreurs» sont connues au cours de la biosynthèse du collagène. Les découvertes récentes dans le domaine de sa structure et de sa biosynthèse ont aussi abouti à la description d’une pathologie très riche du collagène, pathologie qui comprend les maladies héréditaires (ostéogenèse imparfaite) et aussi les maladies acquises (scorbut, par exemple). Ainsi, une des maladies les plus fréquentes, le diabète juvénile et «biologique», implique une dérégulation de la biosynthèse du collagène caractérisée (entre autres) par un épaississement des lames basales des capillaires.Des modifications avec l’âge ont aussi été beaucoup étudiées, car, depuis les études classiques de F. Verzar, on sait que la résistance du collagène augmente avec l’âge, aussi bien sa résistance mécanique (à l’étirement) que sa résistance à l’attaque des enzymes spécifiques pouvant la dégrader (les collagénases; fig. 5 b).Cette modification des propriétés physico-chimiques du collagène avec l’âge permet de déterminer, en médecine légale, l’âge approximatif d’individus décédés. Cela s’effectue sur le tendon du diaphragme par l’étude de sa résistance à la digestion par la collagénase ou à sa résistance à la contraction thermique.Parmi les nombreuses anomalies reconnues, mentionnons les sept types distincts de maladies d’Ehlers-Danlos qui sont des maladies héréditaires et impliquent des anomalies de la biosynthèse des collagènes. Une autre maladie connue depuis longtemps et qui concerne la biosynthèse du collagène est le scorbut. Notamment la vitamine C où l’acide ascorbique est indispensable pour l’hydroxylation de la proline et de la lysine (en hydroxyproline et en hydroxylysine) et, au cours des carences en vitamine C, la biosynthèse de plusieurs types de collagène devient défectueuse. Or, les lames basales assurent la résistance des capillaires et quand leur synthèse est défectueuse la fragilité capillaire augmente.Comme le collagène de type I forme la majeure partie (face=F0019 黎 80 p. 100) de la trame fibreuse des tissus calcifiables tels que l’os, les modifications de sa biosynthèse à ce niveau donnent des malformations congénitales, difficilement compatibles avec la survie des individus, comme les ostéogenèses imparfaites ou la maladie d’Albers-Schönberg (maladie des os en marbre).Le collagène joue un rôle important dans le processus de cicatrisation. La guérison des plaies comporte la prolifération cellulaire (des fibroblastes) au sein du réseau fibrine-fibronectine qui remplit la plaie primitive (caillot) et par la resynthèse de la trame fibreuse (riche en collagène) par ces cellules. Les anomalies de la synthèse et du pontage du collagène (comme dans les phénomènes inflammatoires chroniques) conduisent à des anomalies de la cicatrisation, étudiée en France par A. Delaunay et S. Bazin. Avec l’âge, la synthèse du collagène reste constante ou augmente, contrairement à la synthèse d’autres constituants de la matrice intercellulaire. Ainsi, les tissus s’enrichissent en collagène, ce que l’on a appelé les fibroses ou scléroses, accompagnant le vieillissement (artériosclérose). Dans certains états pathologiques (fibrose pulmonaire primitive par exemple), on note aussi une sursynthèse localisée de collagène (cirrhose: sursynthèse de collagène dans le foie). L’inhibition du pontage du collagène produit aussi une pathologie bien caractéristique, comme le lathyrisme, les malformations squelettiques, les anévrismes, etc. (la maladie de Marfan par exemple).6. Utilisation industrielleÀ part sa pathologie, le collagène est important aussi pour son utilisation industrielle. Ainsi, une des plus anciennes industries de l’humanité, celle des colles, est basée sur la transformation du collagène en gélatine. L’étymologie du mot «collagène» rappelle aussi cette utilisation. Cela a surtout été effectué avec le collagène des os. Une autre industrie ancestrale du collagène est celle du tannage ou l’industrie du cuir. Le cuir n’est autre que du collagène du derme spécialement traité avec des agents tannants, c’est-à-dire ponté d’une façon spéciale, pour lui donner souplesse et résistance. Une variante de cette industrie est celle de la conservation des animaux ou des cadavres humains (momification): le tannage du derme permet la conservation des téguments en les protégeant de la dégradation bactérienne.Plus récemment, on a utilisé le collagène en médecine et en chirurgie. Le catgut est le collagène de la sous-muqueuse intestinale. Cette même sous-muqueuse est utilisée pour les instruments de musique, pour la fabrication des cordes. On a préparé également des pansements à base de collagène (par exemple pour les brûlés, avec la peau de porc) ainsi que des produits cosmétiques (crème au collagène). La gélatine a été largement utilisée aussi dans l’industrie alimentaire.
D’autres types de liaisons intercaténaires sont aussi connues. Comme l’hydroxylysine et ses formes glycosylées peuvent également entrer dans ces liaisons pontiques (pour former par exemple l’hydroxy-lysinonorleucine), on connaît un grand nombre de ponts intercaténaires dont la fréquence varie d’un collagène à l’autre et se modifie aussi au cours du développement, au cours de la cicatrisation et au cours d’états pathologiques. Le pontage du collagène peut être inhibé par des agents chélatant le cuivre (cofacteur de la lysyle-oxydase) et en particulier par les lathyrogènes ( 廓-amino propionitrile par exemple). Ces pontages stabilisent les molécules les unes par rapport aux autres et confèrent une très grande rigidité et résistance mécanique aux fibres de collagène. L’épaisseur des fibres est réglée par le nombre de protofibrilles élémentaires juxtaposées. La régulation de cette épaisseur fibrillaire joue un rôle important dans l’organogenèse et dans la morphogenèse. Ainsi, la transparence de la cornée est due à la très grande régularité du diamètre et de l’orientation des fibres de collagène synthétisées (fig. 4), avec une disposition en «patron» hexagonal, bien caractéristique. Dans les taies cornéennes, à la suite de blessures ou de brûlures cornéennes, cette synthèse s’effectue mal, l’épaisseur des fibres devient très variable ainsi que leur orientation, d’où la perte de la transparence de la cornée. Des modifications analogues de structure et de microarchitecture des fibres se retrouvent dans d’autres tissus aussi au cours de modifications pathologiques (fibroses, scléroses, cicatrisation pathologique).Les détails de biosynthèse sont légèrement différents pour les autres types de collagène; ainsi, pour le collagène de type III, la formation de ponts disulfures entre les chaînes 見 s’effectue non seulement au niveau des terminaisons N- et C-terminales, mais aussi dans la partie triple hélicoïdale de la chaîne, et ainsi ces trois chaînes restent plus fortement associées après le découpage des deux terminaisons et ne peuvent être séparées après dénaturation par chauffage, seulement après réduction des ponts disulfures.En ce qui concerne le collagène des lames basales (de type IV), il reste sous forme de procollagène après sa synthèse, les extensions N- et C-terminales ne sont pas coupées. C’est pourquoi ce type de collagène ne forme pas de fibrilles avec une périodicité caractéristique comme les collagènes interstitiels dont la périodicité de 640 nanomètres, très apparente sur les images de microscopie électronique, est due à ce décalage d’un quart de longueur d’une molécule par rapport à l’autre (fig. 5 a).Les différents types de collagène peuvent être caractérisés par des méthodes physico-chimiques, chimiques et ultrastructurales (par microscopie électronique), et par des méthodes histochimiques (microscopie optique). Les collagènes interstitiels peuvent être colorés avec le bleu d’aniline, selon la méthode au trichrome de Masson ou par le vert lumière, mais sa structure fine ne peut être visualisée qu’en microscopie électronique. Une nouvelle méthode permet la coloration sélective en rouge ou jaune du collagène de type I et en vert du collagène de type III (Junqueira).Les méthodes de caractérisation chimique comportent une étape d’extraction et de solubilisation des collagènes nécessitant des solvants tels que le NaCl 0,1 à 0,5 M, l’acide acétique 0,1 N, l’acide citrique, mais, le plus souvent, on a recours à une protéolyse ménagée avec la pepsine suivie de fractionnement par précipitation saline, par filtration sur gel, par chromatographie échangeuse d’ions ou par électrophorèse en gel de polyacrylamide (après séparation des chaînes 見, voir ci-dessus).L’identification des différents types de collagène peut être effectuée in situ par des méthodes immunochimiques (immunofluorescence) en utilisant des anticorps spécifiques ou par extraction, séparation des chaînes 見 et identification par électrophorèse en gel de polyacrylamide, ou, après clivage des molécules par le bromure de cyanogène (CNBr) au niveau des résidus de méthionine, par identification des produits de clivage (CNBr-peptides), par chromatographie sur colonne ou par électrophorèse sur gel de polyacrylamide.5. Pathologie du collagèneDe nombreuses «erreurs» sont connues au cours de la biosynthèse du collagène. Les découvertes récentes dans le domaine de sa structure et de sa biosynthèse ont aussi abouti à la description d’une pathologie très riche du collagène, pathologie qui comprend les maladies héréditaires (ostéogenèse imparfaite) et aussi les maladies acquises (scorbut, par exemple). Ainsi, une des maladies les plus fréquentes, le diabète juvénile et «biologique», implique une dérégulation de la biosynthèse du collagène caractérisée (entre autres) par un épaississement des lames basales des capillaires.Des modifications avec l’âge ont aussi été beaucoup étudiées, car, depuis les études classiques de F. Verzar, on sait que la résistance du collagène augmente avec l’âge, aussi bien sa résistance mécanique (à l’étirement) que sa résistance à l’attaque des enzymes spécifiques pouvant la dégrader (les collagénases; fig. 5 b).Cette modification des propriétés physico-chimiques du collagène avec l’âge permet de déterminer, en médecine légale, l’âge approximatif d’individus décédés. Cela s’effectue sur le tendon du diaphragme par l’étude de sa résistance à la digestion par la collagénase ou à sa résistance à la contraction thermique.Parmi les nombreuses anomalies reconnues, mentionnons les sept types distincts de maladies d’Ehlers-Danlos qui sont des maladies héréditaires et impliquent des anomalies de la biosynthèse des collagènes. Une autre maladie connue depuis longtemps et qui concerne la biosynthèse du collagène est le scorbut. Notamment la vitamine C où l’acide ascorbique est indispensable pour l’hydroxylation de la proline et de la lysine (en hydroxyproline et en hydroxylysine) et, au cours des carences en vitamine C, la biosynthèse de plusieurs types de collagène devient défectueuse. Or, les lames basales assurent la résistance des capillaires et quand leur synthèse est défectueuse la fragilité capillaire augmente.Comme le collagène de type I forme la majeure partie (face=F0019 黎 80 p. 100) de la trame fibreuse des tissus calcifiables tels que l’os, les modifications de sa biosynthèse à ce niveau donnent des malformations congénitales, difficilement compatibles avec la survie des individus, comme les ostéogenèses imparfaites ou la maladie d’Albers-Schönberg (maladie des os en marbre).Le collagène joue un rôle important dans le processus de cicatrisation. La guérison des plaies comporte la prolifération cellulaire (des fibroblastes) au sein du réseau fibrine-fibronectine qui remplit la plaie primitive (caillot) et par la resynthèse de la trame fibreuse (riche en collagène) par ces cellules. Les anomalies de la synthèse et du pontage du collagène (comme dans les phénomènes inflammatoires chroniques) conduisent à des anomalies de la cicatrisation, étudiée en France par A. Delaunay et S. Bazin. Avec l’âge, la synthèse du collagène reste constante ou augmente, contrairement à la synthèse d’autres constituants de la matrice intercellulaire. Ainsi, les tissus s’enrichissent en collagène, ce que l’on a appelé les fibroses ou scléroses, accompagnant le vieillissement (artériosclérose). Dans certains états pathologiques (fibrose pulmonaire primitive par exemple), on note aussi une sursynthèse localisée de collagène (cirrhose: sursynthèse de collagène dans le foie). L’inhibition du pontage du collagène produit aussi une pathologie bien caractéristique, comme le lathyrisme, les malformations squelettiques, les anévrismes, etc. (la maladie de Marfan par exemple).6. Utilisation industrielleÀ part sa pathologie, le collagène est important aussi pour son utilisation industrielle. Ainsi, une des plus anciennes industries de l’humanité, celle des colles, est basée sur la transformation du collagène en gélatine. L’étymologie du mot «collagène» rappelle aussi cette utilisation. Cela a surtout été effectué avec le collagène des os. Une autre industrie ancestrale du collagène est celle du tannage ou l’industrie du cuir. Le cuir n’est autre que du collagène du derme spécialement traité avec des agents tannants, c’est-à-dire ponté d’une façon spéciale, pour lui donner souplesse et résistance. Une variante de cette industrie est celle de la conservation des animaux ou des cadavres humains (momification): le tannage du derme permet la conservation des téguments en les protégeant de la dégradation bactérienne.Plus récemment, on a utilisé le collagène en médecine et en chirurgie. Le catgut est le collagène de la sous-muqueuse intestinale. Cette même sous-muqueuse est utilisée pour les instruments de musique, pour la fabrication des cordes. On a préparé également des pansements à base de collagène (par exemple pour les brûlés, avec la peau de porc) ainsi que des produits cosmétiques (crème au collagène). La gélatine a été largement utilisée aussi dans l’industrie alimentaire.
collagène [ kɔlaʒɛn ] n. m.• 1873; de colle et -gène♦ Biochim. Protéine fibreuse de la substance intercellulaire du tissu conjonctif. Crème au collagène.
● collagène nom masculin Protéine la plus abondante du corps humain, responsable de la cohésion des tissus.collagènen. m. et adj. BIOCHIMd1./d n. m. Protéine de structure fibreuse qui constitue l'essentiel de la trame conjonctive.d2./d adj. Qui donne de la gélatine ou de la colle par cuisson.⇒COLLAGÈNE, adj. et subst. masc.BIOCHIMIEI.— Adj. Qui produit de la colle ou de la gélatine en se transformant sous l'effet de la chaleur. Substance, éléments collagènes; former de la substance collagène (J. ROSTAND, La Vie et ses problèmes, 1939, p. 59) :• 1. Momigliano Levi (1930) a cultivé des fragments de tendons. Il observe au niveau de la zone de migration, dans les cultures de neuf jours, de nombreuses fibrilles collagènes très fines qui ne montrent pas d'abord une orientation bien nette.J. VERNE, La Vie cellulaire hors de l'organisme, 1937, p. 119.Rem. On rencontre dans la docum. l'adj. collagénique, employé comme synon. de collagène. Substance collagénique (J. BÉRARD, J. GOBILLIARD, Cuirs et peaux, 1947, p. 31).II.— Subst. Protéine constituant l'essentiel de la substance intercellulaire du tissu conjonctif. Les groupements basiques du collagène, les maladies du collagène (QUILLET Méd. 1965, p. 328) :• 2. Dans les procédés à deux bains, la peau est plongée dans une première solution d'acide chromique qui se dépose sur les fibres en donnant avec elles une combinaison instable, puis dans une deuxième solution qui transforme en oxyde basique, lequel réalise avec le collagène la combinaison stable du cuir tanné.J. BÉRARD, J. GOBILLIARD, Cuirs et peaux, 1947, p. 83.Prononc. :[ ]. [ll] double ds LITTRÉ. Étymol. et Hist. 1873 (A. WURTZ, Dict. de chim. pure et appliquée, t. 2, 1er vol., p. 577 : ... substances [...] auxquelles on a donné le nom de collagènes). Dér. de colle d'apr. l'étymon gr.
]. [ll] double ds LITTRÉ. Étymol. et Hist. 1873 (A. WURTZ, Dict. de chim. pure et appliquée, t. 2, 1er vol., p. 577 : ... substances [...] auxquelles on a donné le nom de collagènes). Dér. de colle d'apr. l'étymon gr.  ; élément suff. -gène. Fréq. abs. littér. :1.DÉR. Collagénose, subst. fém., méd. Maladie provoquée par une formation anormale de collagène dans les tissus conjonctifs, les artères, etc. (cf. P. RAVAULT, G. VIGNON, Rhumatologie clinique, 1956, p. 560). — 1re attest. 1956 id.; de collagène, suff. -ose.BBG. — Ac. (L') des sc. prend de nouvelles décisions rel. au lang. sc. Déf. Lang. fr. 1970, n° 55, p. 28, [s.v. collagénose].collagène [kɔlaʒɛn] adj. et n. m.ÉTYM. 1869, adj.; 1873, n. m.; de colle, et -gène.❖♦ Chim., biol. || Substances collagènes, susceptibles de devenir solubles en se transformant en des corps ayant l'apparence et les propriétés générales de la colle de poisson ou de la gélatine. || Fibres collagènes qui composent l'armature protéinique.0 En règle générale, la masse totale de tissu interstitiel augmente régulièrement avec l'âge, alors que la masse totale des parenchymes actifs diminue. Les fibres collagènes paraissent plus épaisses et plus compactes.Léon Binet, Gérontologie et Gériatrie, p. 29.♦ N. m. Protéine de la substance intercellulaire du tissu conjonctif, qui se transforme en gélatine par cuisson.❖DÉR. Collagénose.
; élément suff. -gène. Fréq. abs. littér. :1.DÉR. Collagénose, subst. fém., méd. Maladie provoquée par une formation anormale de collagène dans les tissus conjonctifs, les artères, etc. (cf. P. RAVAULT, G. VIGNON, Rhumatologie clinique, 1956, p. 560). — 1re attest. 1956 id.; de collagène, suff. -ose.BBG. — Ac. (L') des sc. prend de nouvelles décisions rel. au lang. sc. Déf. Lang. fr. 1970, n° 55, p. 28, [s.v. collagénose].collagène [kɔlaʒɛn] adj. et n. m.ÉTYM. 1869, adj.; 1873, n. m.; de colle, et -gène.❖♦ Chim., biol. || Substances collagènes, susceptibles de devenir solubles en se transformant en des corps ayant l'apparence et les propriétés générales de la colle de poisson ou de la gélatine. || Fibres collagènes qui composent l'armature protéinique.0 En règle générale, la masse totale de tissu interstitiel augmente régulièrement avec l'âge, alors que la masse totale des parenchymes actifs diminue. Les fibres collagènes paraissent plus épaisses et plus compactes.Léon Binet, Gérontologie et Gériatrie, p. 29.♦ N. m. Protéine de la substance intercellulaire du tissu conjonctif, qui se transforme en gélatine par cuisson.❖DÉR. Collagénose.
Encyclopédie Universelle. 2012.
